山東助推藥品產業(yè)發(fā)展23條來了,鼓勵研發(fā)、暢通渠道、高效便捷
來源:大眾日報
2021-03-26 11:30:03
原標題:山東助推藥品產業(yè)發(fā)展23條來了,鼓勵研發(fā)、暢通渠道、高效便捷
來源:大眾日報
3月26日,記者從省藥監(jiān)局獲悉,日前,山東省藥品監(jiān)督管理局印發(fā)《關于進一步創(chuàng)新監(jiān)管服務促進藥品產業(yè)高質量發(fā)展的二十三條措施》(以下簡稱《措施》)。《措施》共23條,涉及鼓勵藥物研發(fā)創(chuàng)新、支持藥品產業(yè)聚集發(fā)展等六個方面。為加快促進藥品產業(yè)高質量發(fā)展,山東省藥監(jiān)局將工作聚焦在“服務”二字,立足自身職責,研究制定《措施》。
鼓勵研發(fā),加快提升藥物創(chuàng)新能力
藥物的研發(fā)能力是企業(yè)的核心競爭力,也是企業(yè)持續(xù)發(fā)展的關鍵。“2021年,我省在新藥研發(fā)領域取得欣喜成績,宣肺敗毒顆粒、‘全球新’生物新藥泰它西普等藥物獲批上市。但總體而言,山東省藥物創(chuàng)新能力還有待提高。”山東省藥監(jiān)局注冊處處長曹森介紹,藥物研究主要包括臨床前研究和臨床研究兩個階段,《措施》通過推動提升藥物研制能力建設、強化臨床試驗能力建設措施幫助企業(yè)在兩個階段補齊短板。
為提升藥物研制能力,《措施》提出,指導建立以企業(yè)為主體,高校、科研院所及專業(yè)第三方機構為補充的藥物研發(fā)體系,并鼓勵搭建平臺,促進藥物研發(fā)的供需合作。這就意味著,企業(yè)可以借助外力搞藥物創(chuàng)新,解決當前自主研發(fā)能力不足問題。
“山東目前有藥物臨床試驗機構60多家,是5年前的5倍。從數量來看,基本能夠滿足我省臨床試驗需求,但整體水平還不高,承擔的多中心臨床試驗偏少。當前的主要任務是臨床試驗機構由增量到提質的轉變。”曹森介紹,《措施》要求充分發(fā)揮國家藥監(jiān)局藥物臨床研究重點實驗室的示范帶動作用,加強臨床試驗機構的培訓交流,整體提升臨床試驗能力水平。此外,山東省藥監(jiān)局聯(lián)合省衛(wèi)生健康委已于近日推動成立臨床試驗倫理審查互認聯(lián)盟,解決多中心臨床試驗倫理審查效率低、標準程序不統(tǒng)一等問題。
暢通渠道,加強技術指導服務
2020年,《藥品注冊管理辦法》《藥品生產監(jiān)督管理》辦法陸續(xù)頒布實施,新法規(guī)實施初期,不少企業(yè)對政策理解不透徹,對技術的把握不充分。針對這類問題,《措施》要求暢通溝通渠道,加強技術指導服務。
在暢通溝通渠道方面,《措施》優(yōu)化咨詢服務機制,提出構建一體化在線咨詢服務平臺,實現智能答疑、專家答疑、共性問題答復等服務,并以面對面咨詢?yōu)檠a充。還將不定期組織藥品注冊研討會、座談會,幫助企業(yè)了解國家政策新動向。此外,《措施》重視與國家層間的交流合作,將加強實訓基地建設,定期邀請高水平審評專家現場授課,開展技術文件解讀及指導,解答企業(yè)在新藥研發(fā)和注冊申報過程中遇到的難題。
《措施》強化全過程指導,加強技術指導服務。提出實施藥品重點建設項目、重大創(chuàng)新產品跟蹤服務制,建立品種項目清單,確定工作專班,提前介入,“一對一”提供研發(fā)、檢驗檢測、臨床試驗、注冊、生產上市等全過程服務。例如,加強生物樣本檢測、一致性評價復核能力建設,服務一致性評價工作加快實施;持續(xù)推進藥品醫(yī)療器械創(chuàng)新和監(jiān)管服務大平臺建設,對首仿藥、仿制藥一致性評價品種的注冊檢驗,開辟綠色通道,加快檢驗檢測。
此外,《措施》還支持藥品產業(yè)聚集發(fā)展,助力特色園區(qū)建設。如:實行重點園區(qū)聯(lián)系點制度,落實專門人員,提供政策咨詢和技術服務;加強與重點市地的溝通協(xié)作,指導園區(qū)積極對接藥物創(chuàng)新資源聚集區(qū),打造新藥研發(fā)與藥品生產互為支撐、相互促進的發(fā)展體系等。
高效便捷,優(yōu)化審評審批流程
以優(yōu)質的審評審批服務促進藥品產業(yè)高質量發(fā)展,是藥監(jiān)部門的職責所在。《措施》本著“標準不降、程序合規(guī)、流程優(yōu)化、速度加快”的原則,深化行政審批制度改革,通過有條件豁免現場檢查、加強上市后變更等舉措實現審批環(huán)節(jié)提質增效。
在審評審批方面,對所有行政許可和備案事項實行網上辦理,實施創(chuàng)新、快捷、常規(guī)“三通道”審批,對創(chuàng)新產品、省級以上重大科技項目以及省重點建設項目實施優(yōu)先審評審批。
《措施》對審評審批環(huán)節(jié)進行優(yōu)化,提升工作效率、減輕企業(yè)負擔。例如:有條件豁免現場檢查;對于上市后變更生產場地的,生產許可變更、GMP符合性檢查、注冊核查合并實施,非特殊情形的不再安排注冊檢驗;藥品零售企業(yè)并入其他藥品零售連鎖經營企業(yè),如其實際注冊地址、經營范圍未發(fā)生變化的,可按變更藥品經營許可證辦理等。
同時,鼓勵省內企業(yè)取長補短,發(fā)揮各自優(yōu)勢加快發(fā)展,并在審批環(huán)節(jié)給予政策支持。如鼓勵研制機構持有文號委托生產,對于研制機構申請藥品生產許可證的,予以優(yōu)先辦理;支持代加工生產,充分發(fā)揮制造能力強的優(yōu)勢,鼓勵承接委托加工業(yè)務,加快辦理生產許可、GMP符合性檢查等事項,著力打造高端生物制藥合同生產基地。
此外,《措施》還在促進藥品流通集約發(fā)展、強化質量管控等方面提出支持舉措,如推進倉儲資源整合利用、開展多倉協(xié)同試點、鼓勵藥品經營企業(yè)跨區(qū)域配送等。(大眾日報客戶端記者 楊潤勤 報道)

想爆料?請登錄《陽光連線》( https://minsheng.iqilu.com/)、撥打新聞熱線0531-66661234或96678,或登錄齊魯網官方微博(@齊魯網)提供新聞線索。齊魯網廣告熱線0531-81695052,誠邀合作伙伴。
山東共青團:以黨史學習教育 引領青年奮進新征程
- 今天為大家播報的是《黨史故事——南湖的紅船》……”近日,在臨沂市蘭山區(qū)白沙埠鎮(zhèn)東安靜村蒲公英廣播站,兩位少先隊小廣播員正在向村民播...[詳細]
- 新華社 2021-03-26
山東前兩個月社會消費品零售總額達4983.6億元
- 近日,記者從山東省統(tǒng)計局獲悉,1-2月,消費升級以及春節(jié)、低基數等因素促消費市場開門紅,山東省實現社會消費品零售總額4983.6億元,同比...[詳細]
- 魯網 2021-03-26
山東省首批教育強鎮(zhèn)筑基試點鄉(xiāng)鎮(zhèn)名單公布 青島5個鄉(xiāng)鎮(zhèn)上榜
- 青島膠州市李哥莊鎮(zhèn)、即墨區(qū)移風店鎮(zhèn)、萊西市姜山鎮(zhèn)、西海岸新區(qū)泊里鎮(zhèn)、平度市明村鎮(zhèn)等5個鎮(zhèn)上榜。據介紹,當前,義務教育發(fā)展不均衡的問...[詳細]
- 青島日報 2021-03-26
山東首例侵害未成年人強制報告案宣判 男子性侵10歲少女獲刑12年
- “被告人劉某某犯強奸罪,判處有期徒刑十二年。”據山東省人民檢察院消息,日前,由威海乳山市人民檢察院提起公訴的一起性侵未成年人犯罪案...[詳細]
- 大眾網 2021-03-26
周知!3月27日21時至3月28日21時,交管平臺暫停服務
- 青島日報社/觀海新聞3月26日訊觀海新聞記者今日從青島市車管所了解到,3月27日(周六)21時至3月28日(周日)21時對公安交通管理綜合應用...[詳細]
- 青島日報 2021-03-26
毓璜頂醫(yī)院公益直播課第54期:微創(chuàng)技術在胃腸外科的應用
- 膠東在線3月26日訊上達食管下端,下至直腸、結腸、肛門,治療范圍貫穿整個腹段消化道,煙臺毓璜頂醫(yī)院胃腸外一科以消化系統(tǒng)疾病微創(chuàng)診療為...[詳細]
- 膠東在線 2021-03-26
煙臺消防聯(lián)合文旅部門開展互聯(lián)網營業(yè)場所火患排查“十日攻堅戰(zhàn)”
- 煙臺消防聯(lián)合文旅部門開展“十日攻堅戰(zhàn)”互聯(lián)網營業(yè)場所查隱患行動,3月24日,專項整治“攻堅隊”走進轄區(qū)網吧,開展消防安全隱患排查整治...[詳細]
- 膠東在線 2021-03-26
快訊:12個項目!總投資131億元!自貿區(qū)煙臺片區(qū)再添新動力
- 在3月26日舉行的2021中國(山東)自貿試驗區(qū)煙臺片區(qū)推介會暨重點項目集中簽約儀式上,12個總投資131億元的項目集中簽約,為煙臺自貿片區(qū)發(fā)展...[詳細]
- 膠東在線 2021-03-26
東營經開區(qū)勝利街道:“四鄰”責任社區(qū)創(chuàng)新基層治理
- 新華社客戶端濟南3月26日電(吳書光、張勇)連日來,在東營經濟技術開發(fā)區(qū)勝利街道錦苑社區(qū)錦苑廣場,藍天白云、紅毯滿地的“濕地風光”讓...[詳細]
- 新華社 2021-03-26
獲獎名單來了!山東縣融中心參加《小康中國·千城早餐》第二季獲佳績
- 新華社客戶端濟南3月26日電(鐘欣)近日,《小康中國·千城早餐》第二季獲獎名單公布,山東2部作品上榜。在《小康中國·千城早餐》第一季視...[詳細]
- 新華社新聞信息中心山東中心 2021-03-26
濰坊銀行“尊長專屬”客服熱線開通運行 打造更貼心的金融服務
- 3月26日,濰坊銀行創(chuàng)新推出的“尊長專屬”客服熱線正式開通。此舉旨在通過電話銀行人工座席向老年人提供溫暖細致的關懷,打造有溫度的金融...[詳細]
- 魯網 2021-03-26
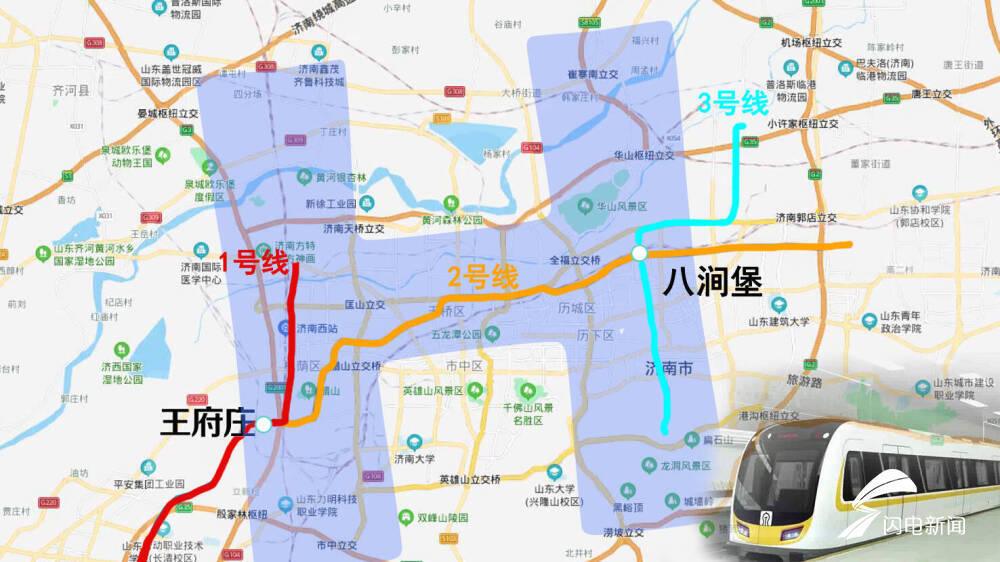
全攻略!濟南地鐵2號線今天正式運營,路線票價換乘都在這
- 今天早上,濟南軌道交通2號線正式開始初期運營濟南進入地鐵換乘時代。9條公交同時開通接駁為了配合地鐵2號線的開通,優(yōu)化濟南市公交線網布...[詳細]
- 大眾網 2021-03-26
鼓勵研發(fā) 暢通渠道|山東出臺23條助推藥品產業(yè)發(fā)展
- 記者從“山東藥品監(jiān)管”微信公眾號獲悉,山東省藥品監(jiān)督管理局印發(fā)《關于進一步創(chuàng)新監(jiān)管服務促進藥品產業(yè)高質量發(fā)展的二十三條措施》(以下...[詳細]
- 魯網 2021-03-26